Die Therapieempfehlungen basieren auf den ELN-Guidelines 2013 und definieren den aktuellen Standard in der Therapie eines MDS.
- Niedrigrisiko MDS (IPSS: niedrig/intermediär-1; IPSS-R: sehr niedrig, niedrig und intermediär*)
- Hochrisiko MDS (IPSS: intermediär-2/hoch; IPSS-R: hoch und sehr hoch)
Niedrigrisiko MDS (IPSS: niedrig/intermediär-1; IPSS-R: sehr niedrig, niedrig und intermediär*)
ohne symptomatische Zytopenien und
- Patient mit < 5% Blasten, keine schlechte Zytogenetik oder Mutationen: watch and wait
- Patient ≤ 65-70 Jahren, schlechte Zytogenetik oder rasche Progression: Stammzellspender suchen für allogene hämatopoetische Stammzelltransplantation (allo-HSZT) oder hypomethylierende Agenzien (HMA: Azacitidine, Decitabine)
bei symptomatischer Anämie: Erythrozytentransfusion und Eisenchelationstherapie, sowie bei
- Patient mit Serumerythropoetin < 500mU/ml und/oder RBC < 2/Monat: Erythropoetin Stimulierende Agenzien (ESA)
- Patient mit MDS del(5q):
- Serumerythropoetin < 500mU/ml und/oder RBC < 2/Monat: Zuerst ESA und bei Versagen starten mit Lenalidomid (LEN)
- Serumerythropoetin ≥ 500mU/ml und/oder RBC ≥ 2/Monat: Lenalidomid
- Patient mit hypoplastisches MDS, Blastenanteil <5%, normale Zytogenetik: Immunsuppressive Therapie mit ATG plus CSA (IST) erwägen, ggf in Kombination mit Thrombopoietin-Rezeptor-Agonisten (TPO-RA).
Hochrisiko MDS (IPSS: intermediär-2/hoch; IPSS-R: hoch und sehr hoch)
Patient ≥ 65-70 Jahre, schlechter Allgemeinzustand oder limitierende Komorbiditäten: HMA und supportive care
Patient < 65 Jahre mit gutem Allgemeinzustand ohne limitierende Komorbiditäten
- mit passendem Stammzellspender und
- Blastenanteil < 10%: direkte allo-HSZT ohne Induktion
- Blastenanteil ≥ 10%: AML-ähnliche Induktions-Chemotherapie oder HMA mit anschliessender allo-HSZT
- ohne passendem Stammzellspender und
- schlechte Zytogenetik oder TP53 Mutationen: HMA
- ≥ 10% Blasten aber keine schlechte Zytogenetik: HMA und supportive care
(* bei fehlenden Hoch-Risiko Veränderungen: refraktär auf ESA, LEN und IST; >3 somatische Driver-Gen Mutationen; Mutationen in TP53, RUNX1, ASXL1, ETV6, EZH2, SRSF2, U2AF1, RAS-Pathway und JAK2 (VAF > 2%); relevante Knochenmarksfibrose ≥ Grad 2)
weitere Algorithmen
Zudem verweisen wir gerne auf den folgenden Behandlungsalgorithmen.
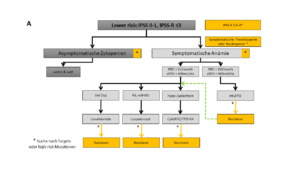
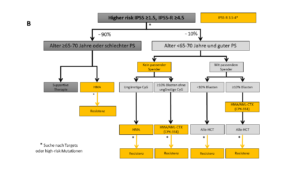
Allo-HCT: allogene hämatopoetische Stammzelltransplantation; AML-CTX: AML-basierte Chemotherapie; ATG: Antithymozytenglobulin; BM: Knochenmark; CSA: Cyclosporin A; CyG: Zytogenetik; ESA: Erythropoietin-stimulierendes Mittel; HMA: Hypomethylierungsmittel; HR: Hochrisiko-Mutationen; mSF3B1: mutiertes SF3B1; PB: peripheres Blut; PS: Leistungsstatus; RBC: Erythrozytenkonzentrat; RS: Ringsideroblasten; sEpo: Serumerythropoietin; TPO-RA: Thrombopoietin-Rezeptor-Agonist. Die gelben Kästchen markieren Bereiche mit einem ungedeckten Bedarf an klinischen Studien.
Chanias I et al. Cancers 2021, 13(13), 3296; Bonadies N. EMJ Hematol. 2017;5[1]:104-112; Malcovati L et al. Blood. 2013;122(17): 2943-64
